北京時間2024年7月25日,國際頂級期刊《新英格蘭醫學雜志》 (《New England Journal Of Medicine》,NEJM,IF:96.2)在線發表了北京協和醫院風濕免疫科曾小峰教授、李夢濤教授及血液內科周道斌教授牽頭的靶向CD19嵌合抗原受體自體T(CD19
CAR-T)細胞注射液(納基奧侖賽注射液)治療系統性紅斑狼瘡相關免疫性血小板減少癥(SLE-ITP)的研究論文“Anti-CD19 CAR T cells in refractory immune thrombocytopenia of
SLE”, 該報道展現了CAR-T(納基奧侖賽)治療在系統性紅斑狼瘡免疫性血小板減少癥中良好并持久的療效和安全性,顯示了CAR-T在SLE及ITP治療中的應用潛力。

系統性紅斑狼瘡(SLE)是一種慢性系統性自身免疫性疾病,常導致全身多器官損害,B細胞異常及自身抗體產生在其發病中起到至關重要的作用。SLE可引起免疫性血小板減少,在中國SLE患者中占16%,其中相當一部分患者對糖皮質激素、免疫抑制劑和生物制劑均反應不佳,此類患者預后不佳,長期存在重要臟器出血風險,是SLE治療中的一大難點。
該文章報道一例女性患者,于2014年確診系統性紅斑狼瘡,存在持續性重度免疫性血小板減少癥。該患者既往接受甲潑尼龍沖擊、羥氯喹、靜脈注射免疫球蛋白、他克莫司、環孢素、西羅莫司、利妥昔單抗、達那唑、艾曲波帕和促血小板生成素治療均無效,血小板計數始終處于20×109/L以下,并伴有皮膚黏膜出血表現。該患者于2023年9月接受自體CD19 CAR-T(納基奧侖賽)細胞一次回輸并持續隨訪。
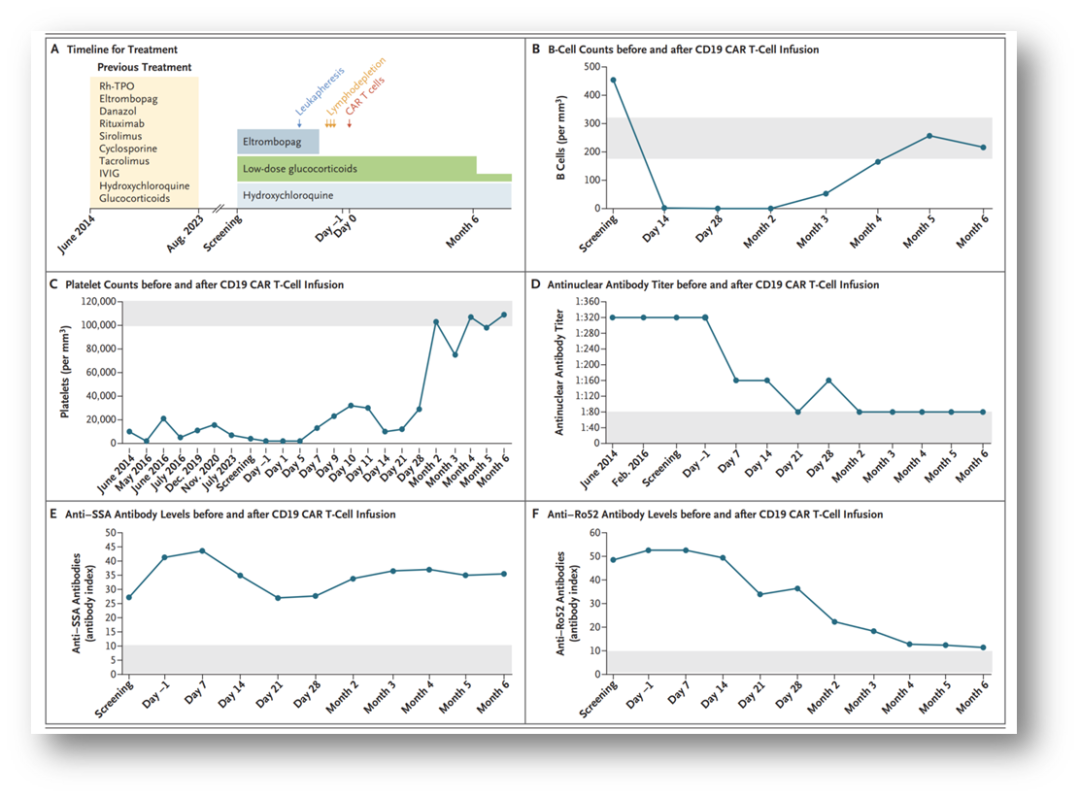
應用CD19 CAR T細胞治療系統性紅斑狼瘡患者難治性血小板減少癥
圖中顯示該患者的治療時間表,包括重組人血小板生成素(Rh-TPO)和靜脈注射免疫球蛋白(IVIG)(圖A)。CD19嵌合抗原受體(CAR)T細胞的劑量為0.5×106個細胞/kg體重。圖中還顯示CD19 CAR T細胞輸注之前和之后的B細胞計數(圖B)和血小板計數(圖C),以及在生理鹽水中測定的血清抗核抗體滴度(圖D)。圖中顯示抗SSA(干燥綜合征抗原A)抗體(圖E)和抗Ro52抗體(圖F)變化情況。在圖B至F中,灰色陰影區域表示正常范圍。
患者治療療效:納基奧侖賽注射液回輸后CAR-T細胞在患者體內擴增良好,回輸第28天血液中CD19陽性B細胞被清除,第三個月時B細胞重建。血小板計數治療后的六個月內持續上升,由4×109/L上升到第一個月時的29×109/L ,第三個月75×109/L,第六個月109×109/L,達到臨床完全緩解,且患者停用了糖皮質激素和所有免疫抑制劑。患者抗核抗體滴度也明顯下降。
該患者僅在回輸后第9天出現一過性1級發熱(38.1℃),通過物理降溫恢復正常。未觀察到CAR-T細胞治療相關的其他不良事件。
接受治療的患者王女士(化名):
“這個病(難治性系統性紅斑狼瘡相關免疫性血小板減少癥)困擾了我十年,身上經常突然出現出血點,幾乎每天都在擔心自己會不會受傷流血,渾身沒有力氣,精神壓力也特別大。所有的治療方法我也都試過了,但還是特別頑固(血小板沒有增加),用了很多激素治療也不管用,還對股骨頭造成了損傷。感謝北京協和醫院風濕免疫科的醫生團隊,推薦了CAR-T治療(納基奧侖賽)這一新興療法并在治療過程中對我非常關照,我的血小板在接受治療后很快就達到了正常水平,讓我不再過以往這樣擔心的日子,基本回歸了正常生活!”
北京協和醫院風濕免疫科李夢濤教授:
“這一病例是全球首次將CD19 CAR-T細胞療法應用于系統性紅斑狼瘡相關免疫性血小板減少癥的治療,顯示了CAR-T細胞療法治療難治性SLE及難治性ITP的良好療效和巨大應用前景。協和多學科團隊將不斷探索CAR-T細胞療法在難治性自身免疫性疾病中的應用,以期推動自身免疫疾病治療領域的進步,造福廣大患者”
合源生物首席執行官呂璐璐博士:
“對于納基奧侖賽注射液在治療難治性系統性紅斑狼瘡血小板減少癥方面取得的研究成果在《New
England Journal Of Medicine》上發表,我們感到極為振奮。這一里程碑式的成果不僅僅是“全球首個”,更有力證明了納基奧侖賽注射液在治療自身免疫性疾病的臨床價值和廣闊前景。實現納基奧侖賽注射液臨床價值最大化是我們的重要目標,其治療治療成人復發或難治性B細胞急性淋巴細胞白血病已于2023年11月獲得國家藥監局正式批準上市,治療復發或難治性侵襲性B細胞非霍奇金淋巴瘤和治療兒童和青少年復發或難治B細胞急性淋巴細胞白血病的注冊臨床研究及新藥上市工作也在有序推進過程中。與此同時,治療自身免疫性疾病也是我們的重點疾病領域拓展方向,我們正積極加速推進納基奧侖賽注射液在多類型自身免疫性疾病的臨床研究,加速其臨床應用進程,讓更多患者獲益這一創新療法。”
關于合源生物
合源生物創立于2018年6月,已成長為中國細胞藥物產業自主創新的引領者,致力于成為全球領先的細胞與基因創新技術驅動的新一代生物醫藥企業。公司首個核心產品源瑞達?(納基奧侖賽注射液,CNCT19)于2023年11月正式獲國家藥品監督管理局批準上市。該產品是中國白血病治療領域首個CAR-T藥物,也是中國全自主創新的首個CD19 CAR-T藥物。公司深度合作國家一流院所,構建了以CAR技術平臺、iPSCs技術平臺以及基因編輯技術平臺等為核心的國際化新藥研發體系,擁有覆蓋血液腫瘤、實體腫瘤及自身免疫性疾病等疾病領域的10余種管線產品在研。
源瑞達?(納基奧侖賽注射液,CNCT19,Inaticabtagene Autoleucel Injection)是具有自主知識產權的靶向CD19的CAR-T細胞治療產品,擁有全球獨特的CD19 scFv(HI19a)結構和國際領先的生產制造工藝,先后獲得國家藥品監督管理局三項新藥臨床試驗許可(IND),用于治療成人復發或難治性急性淋巴細胞白血病、治療復發或難治性侵襲性B細胞非霍奇金淋巴瘤和治療兒童和青少年復發或難治B細胞型急性淋巴細胞白血病,并獲得國家藥品監督管理局藥品審評中心“突破性治療藥物”認定和美國FDA孤兒藥資格認定(Orphan Drug Designation, ODD)。2022年12月,國家藥品監督管理局(NMPA)正式受理納基奧侖賽注射液治療成人r/r B-ALL的新藥上市申請(NDA)并納入優先審評。2023年3月,納基奧侖賽注射液用于治療成人r/r B-ALL IND申請也獲得美國食品藥品監督管理局(U.S.FDA)許可。2023年11月,源瑞達?(納基奧侖賽注射液)正式獲中國國家藥品監督管理局(NMPA)批準上市。
公司堅持以滿足臨床需求為導向,通過嚴格的細胞治療產品生產和質量體系,為患者打造安全、高效、可及的免疫細胞治療產品。公司具有世界一流研發技術平臺,工藝開發平臺,質量控制體系以及商業化生產基地,并于2021年6月獲得天津市首張細胞藥物《藥品生產許可證》。公司擁有多項發明專利,入選國家科技部國家重點研發計劃項目即“科技助力經濟2020重點專項項目”。

 查看更多 +
查看更多 +
 010-65960020
010-65960020


